Соляная кислота применяется в изготовлении некоторых ВВ. Сейчас является перекурсором, и приобрести ее в Химмаге не получится. Но ее достаточно просто изготовить в домашних условиях. Химически чистая концентрированная соляная кислота бесцветная, дымящаяся на воздухе жидкость (выделяется хлороводород) с резким запахом. Плотность соляной кислоты составляет 1.19, при концентрации 37 %.
Реактивы:
NaCl – поваренная соль. В принципе подойдет любой хлорид, KCl например.
H2SO4 – серная кислота. Обязательно концентрированная (обугливает спичку в холодном состоянии), вполне подойдет выпаренный электролит.
Защитное снаряжение:
Соляная кислота – ЗЛО! При попадании на кожу вызывает химические ожоги. На одежду ей тоже не следует попадать – разъедает мгновенно. Хлороводород ядовит! Получение соляной кислоты лучше производить на открытом воздухе или в хорошо проветриваемом помещении. Минимум защитных средств: 1. Резиновые перчатки (лучше как на фото). 2. Противогаз ну или респиратор (поможет вам быстро ликвидировать последствия возможной аварии без вреда для здоровья).
Оборудование: 1. Электрическая плитка или другой источник тепла. 2. Весы. 3. Мерный стакан. 4. Реакционный сосуд, я использовал плоскодонную колбу на 250 мл. 5. Предохранительная склянка. Прекрасно подойдет любая колба, (главное, чтобы объем склянки не был меньше объема получаемой кислоты). 6. Пара резиновых пробок. 7. Трубки, можно использовать трубки от капельниц.
В итоге должен получиться вот такой прибор.
Правда тут есть пара нюансов: 1. Трубки, используемые в приборе должны быть одного диаметра, лучше отказаться от использования иголок от шприцов в качестве штуцеров. Это создаст разность в давлении и аппарат рванет (у меня так и случилось при использовании иглы от шприца). 2. Трубку, из которой идет HCl лучше не опускать в воду, так как вода может быть засосана в систему из-за большой растворимости HCl. 3. Предохранительная склянка в принципе необязательна, можно и без нее, но если воду засосет в реакционную колбу и она может лопнуть, разбрызгивая горячую серную кислоту.
Изготовление:
1. Отвешиваем соль примерно 10-20 граммов. Кислоты возьмите примерно столько же 10-15 миллилитров. Я написал примерно потому что количество кислоты зависит от ее концентрации. Я брал 1 : 1 по объему. Если кислота 60-80%, то хлороводород сначала растворится в воде, а только потом будет выделяться.
Короче говоря, МЕНЬШЕ ВОДЫ – Меньше ПРОБЛЕМ! Так что лучше потратить побольше времени на выпаривание электролита.
2. Помещаем соль в реакционную колбу. 3. Собираем установку, проверяем все соединения, они должны быть герметичны. 4. Наливаем в мерный стакан 50-100 мл. воды (желательно дистиллированной) и вставляем в него трубку. 5. Надеваем противогаз. 6. Теперь главное быстро налить серную кислоту в реакционную колбу и заткнуть горлышко газоотводной трубкой. Противогаз спасет вас от хлороводорода, который начнет выделяться. 7. Сначала реакция идет сама, потом колбу нужно чуть-чуть нагреть. NaCl + H2SO4 → Na2SO4 + 2HCl↑
Далее приведены фотографии прибора и всего процесса:
Таким способом можно получить кислоту максимальной концентрации 37-40%. В процессе получения вы увидите, как объем воды, которую вы налили в стакан начнет увеличиваться. Продолжайте насыщать воду до тех пор, пока газ не перестанет растворятся. Хранить кислоту нужно в плотно закрытой таре, во избежании улетучивания HCl. УДАЧИ!
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Причины появления засоров
Канализационная система перемещает сточные воды с большим содержанием органики и жиров. Они налипают на стенки тонким слоем, который постепенно нарастает и превращается в полноценный засор. Как правило, он располагается неподалеку от сливного отверстия кухонных раковин или других сантехнических приборов. Чаще всего от жировых наслоений страдает сифон, изгиб которого активно собирает на себя липкие и вязкие компоненты сточных вод.
Кроме этого, частой причиной становятся посторонние предметы, попадающие в канализацию. Здесь могут оказаться волосы, бумага, строительный мусор (песок, остатки клеевых растворов), женские прокладки и другие нежелательные компоненты. Они застревают в участках изгиба или сужения труб, становятся причиной образования постоянного засора. Никакие методы, кроме механической прочистки, результатов не дают.
На чугунных трубах встречаются случаи отслоения окалины с внутренней поверхности стенок. Она остается внутри и быстро обрастает жиром, задерживает мелкие частицы органики. Решением проблемы также станет механическая чистка труб.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ
Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ
Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
Таблица 1. Рекомендуемая плотность электролита
Что образуется при взаимодействии
Кислотный остаток уже не так опасен, как исходный компонент. Интересно, что именно реакции с выделением углекислого газа сода обязана добавлением её в хлеб – углекислый газ, выделяющийся из-за взаимодействия с молочной кислотой, поднимает тесто и делает в нём пузырьки.
Примерно также происходит реакция нейтрализации: основание вступает в реакцию с H2SO4 и выделяется углекислый газ. Поэтому, чтобы этот химический опыт не превратился в плачевный жизненный, следует проводить его в проветриваемом помещении.
К вопросу о том, сколько соды необходимо для нейтрализации H2SO4. Если взять 1 часть кислоты, пригодится 1 часть щёлочи для реакции с ней, то есть соотношение будет 1:1. Но концентрированная кислота требует больше соды, здесь соотношение увеличится до 1:2. Раствор соды необходим 3%.
Кроме того, если необходимо оказать помощь при ожоге кислотой, то готовится раствор соды в очень приблизительном количестве: 1 чайная ложка щёлочи и на 2,5 стакана воды. Насколько эффективна реакция? В этом помогут разобраться отзывы тех, кто с ней часто сталкивается.
Рекомендовано для Вас:
Как применять и использовать кальцинированную соду в быту
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?
Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.
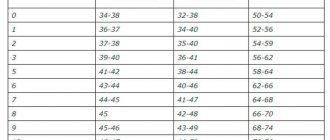
Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Изготовление реактора попытка №2
Проблему с расплавлением реактора я решил заменив пластмасс на дерево. Из куска ОСБ я вырезал кругляш просверлил в нём всё также 3 отверстия два под электроды и один под отвод газов. Дополнил конструкцию также ещё 2 болтами что бы проще было подключать и отключать как клеммы так и электроды, плюсом также было что они повышали герметичность конструкции. Также для удобства я заменил трубу на более короткую и нанёс на низ деревянной пробки силиконовый герметик. Герметик я использовал как прокладку для герметичности.
Болты для удобства подключения
Болты для удобства подключения
Болты для удобства подключения
Теперь вроде не должен плавиться как я подумал в прицепе идея себя оправдала при испытании ни чего не расплавилось однако я упустил другой момент всё таки крышка прилегала не равномерно к банке и следовательно газ выходил из щелей так как не было достаточной герметичности. На скорую руку я постарался решить проблему обычными стяжками от части это помогло но это не решение проблемы.
Использование стяжек
Пришло время конструировать новый реактор не будем сдаваться и продолжим свои исследовательские опыты.
Как правильно приготовить электролит в домашних условиях: техника безопасности
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.
Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
Необходимая плотность раствора
Количество твёрдой щелочи равняется количеству электролита, разделенному на
Электролит является важнейшей составляющей аккумуляторных батарей. Без него невозможна их работа и от качества и правильности приготовления зависят как технические параметры, так и долговечность аккумуляторов.
Сейчас в продаже возможно приобретение электролита для любых разновидностей аккумуляторов, но иногда возникает необходимость в его самостоятельном изготовлении. Приготовить электролит для аккумулятора несложно при выполнении ряда условий.
Состав электролита
Электролит является раствором активного вещества в дистиллированной воде. В зависимости от типа используемых аккумуляторных батарей активным веществом являются:
- серная кислота для свинцово-кислотных аккумуляторов;
- щелочи (едкий натрий или калий) для щелочных аккумуляторов.
В щелочных АКБ для выполнения особых требований в составе электролита может присутствовать добавка едкого лития. Также едкий литий является основным в литий-ионных и литий-полимерных аккумуляторах.
Понадобится
Для проведения опыта нам потребуется:
- Кислотный электролит для аккумуляторов (продаётся в автомагазине);
- Дистиллированная вода (там же);
- Поваренная соль (есть на любой кухне);
- Пищевая сода (см. технику безопасности).
Из посуды необходимо:
- Стеклянная колба;
- Сосуд с песком, куда можно колбу поместить;
- Несколько одноразовых стаканчиков 200 мл;
Если Вы располагаете термостойкой колбой, то можно нагревать её под открытым пламенем горелки. Но всё же рекомендую через песок, в случае чего он впитает в себя кислоту. Также понадобятся пара сантехнических уголков диаметром 50 мм и горелка (в моём случае спиртовая, но рекомендую использовать газовую).
Требования к компонентам
Нормальное протекание химических реакций предъявляет особые требования к веществам электролита. Основное требование – высокая степень чистоты материалов. Чем чище будут химические вещества для приготовления электролита, тем выше будет КПД аккумуляторов и их долговечность.
Согласно требованиям стандартов, аккумуляторная серная кислота должна содержать не менее 92 – 94% серной кислоты. Оставшиеся 6 – 8% занимает вода. Содержание солей металлов не более тысячных долей процента.
Внимание! Щелочь выпускается в сухом виде и к ней предъявляются подобные требования.
Если с перечисленными веществами вопросов обычно не возникает (ответственность за чистоту возлагается на предприятия, выпускающие материалы и торговые организации), то с водой дела обстоят несколько хуже. Многие автолюбители не делают различие между обычной и дистиллированной водой.
Вода из водопровода насыщенна растворами различных солей металлов и органических веществ. Простое кипячение в состоянии избавиться от незначительного количества солей жесткости, а остальные вещества остаются в неизменном виде. В водопроводной воде наиболее опасными для аккумуляторов являются соли железа, находящиеся там в больших концентрациях.
Активные вещества для электролита нужно разводить дистиллированной водой, которая отличается тем, что содержание солей в ней минимально. Такая вода по своим химическим и физическим параметрам практически соответствует идеальной.
Свойства химического спектра
Кислота взаимодействует со многими металлами, солями. Она считается довольно сильной и стоит в одном ряду с серной. Основная реакция проявляется на все группы металлов, находящихся левее от водорода (магний, железо, цинк – электротехнические потенциалы).
Хлороводородный раствор в разбавленном виде вступает в реакцию с солями, но только с теми, которые образованы менее сильными кислотами. Известные всем натрия и кальция карбонат после взаимодействия с ним распадаются на воду и угарный газ.
Азотная кислота
– качественная реакция на солевой раствор. Для ее получения необходимо добавить в этот реактив нитрат серебра, как результат – выпадет осадок белого цвета, с которого получается азотное вещество
С помощью данной смеси воды и водорода проводят множество интересных экспериментов. Например, разбавляют его аммиаком. В итоге, получится белый дым, густой, имеющий консистенцию маленьких кристаллов. Метиламин, анилин, диоксид марганца, калий карбонат – реактивы, также поддающиеся под влияние кислоты.
Плотность электролита
Для заливки в аккумуляторы используются составы с точно определенной концентрацией входящих в состав веществ. Для облегчения контроля количественного состава введено понятие плотности. Это объясняется тем, что дистиллированная вода обладает плотностью, равной 1 гр/см3 и любые посторонние добавки увеличивают это значение. Серная кислота и щелочь, имеют гораздо более высокие значения удельного веса, поэтому, измеряя плотность раствора, можно легко определить состав электролита. Плотность измеряется при помощи простейшего устройства, а о том, как замерять плотность, читайте в этой статье .
Количество исходных веществ
Чтобы приготовить электролит с заданным значением плотности, нужно взять строго определенное количество исходных веществ. В таблице ниже приведены данные по наиболее распространенным значениям плотности для разных типов электролита.
| Плотность, г/см3 | Количество воды, л | Количество кислоты, л | Количество щелочи, кг | Температура замерзания электролита, °С |
| 1,24 | 0,819 | 0,242 | -45 | |
| 1.25 | 0,809 | 0,253 | -50 | |
| 1.26 | 0,8 | 0,263 | -55 | |
| 1.27 | 0,791 | 0,274 | -60 | |
| 1.28 | 0,781 | 0,285 | -65 | |
| 1,15 – 1.21 | 3 | 1 | -19 … +35 | |
| 1.25 – 1.27 | 2 | 1 | -20 … -40 |
Особенности технологии приготовления электролита
При самостоятельном приготовлении следует помнить следующее:
- плотность кислоты и щелочи намного выше плотности воды;
- реакции смешивания кислоты с водой и растворения щелочи происходят с выделением высокой температуры (до 80-90°С);
- кислоты и щелочи взаимодействуют с большинством металлов.
Из перечисленного следует, что посуда для приготовления электролита должна быть из материала, стойкого к действию агрессивных веществ и температуры. Наиболее соответствует этим требованиям посуда из стекла и керамики. Использование пластиковой посуды возможно при условии недопускания ее нагрева до высоких температур. Нельзя использовать эмалированную посуду, поскольку при наличии незаметных трещин в эмали будет происходить загрязнение электролита солями металлов. То же самое относится к изделиям из нержавеющей стали. Такие материалы не вступают в реакцию с водой, но производители не гарантируют ее нейтральность по отношению к агрессивным веществам.
Важно! Перед тем, как сделать электролит, заранее отмеряют необходимое количество компонентов.
Приготовление кислотного электролита
Высокая плотность кислоты и способность разогрева при смешивании с водой обусловили специфику приготовления раствора: кислоту нужно вливать в воду. Если поступить наоборот, то вода, оказавшись сверху, нагреется до температуры закипания и выплеснется наружу вместе с каплями кислоты.
Чтобы уменьшить нагрев, кислоту целесообразно разбавить в два этапа. На первом готовится раствор плотностью 1.40, а затем, после остывания, делают электролит необходимой концентрации. Раствор с плотностью 1.40 называют корректирующим. Он применяется для коррекции плотности электролита в рабочих аккумуляторах. После добавления кислоты в воду смесь аккуратно перемешивают стеклянной палочкой. Приготовленный электролит необходимо оставить на некоторое время (от половины до суток) для его равномерного смешивания и полного остывания.
Внимание! Срок хранения кислотного раствора неограничен.
Приготовление щелочного электролита
Необходимое количество щелочи высыпают в отмеренное количество воды и перемешивают до полного растворения. Также необходимо выдержать время, пока осадок не растворится полностью и температура не опустится до нормальной.
Раствор щелочи нужно хранить в герметично закрытой таре, не допуская попадания воздуха. Углекислый газ легко вступает в реакцию со щелочами с образованием карбонатов – солей угольной кислоты. В результате содержание активного вещества в растворе с течением времени падает.
Растворы кислоты и щелочи должны быть прозрачными или иметь легкий желтоватый оттенок. Наличие мутности отстоявшегося раствора говорит о низкой чистоте исходных компонентов и для использования в аккумуляторах непригодны.
Хранение и транспортировка
Хранят и транспортируют соляную техническую кислоту в специализированных покрытых полимерами цистернах и контейнерах, бочках из полиэтилена, стеклянных бутылях, упаковываемых в ящики. Люки контейнеров и цистерн, пробки бочек и бутылей должны обеспечивать герметичность емкости. Кислотный раствор не должен контактировать с металлами, находящимися в линейке напряжения левее водорода, так как это может стать причиной возникновения взрывоопасных смесей.
Меры безопасности
Приготовление электролита представляет собой опасность из-за использования очень агрессивных веществ. Концентрированные растворы кислоты и щелочей способны вызвать труднозаживающие кислотные ожоги, а при попадании в глаза вызывают слепоту.
Перед работой следует приготовить нейтрализующий раствор для смывки случайно попавших на тело капель электролита:
- 1% раствор пищевой соды при работе с кислотой.
- Столовый уксус для обезвреживания щелочи. Уксус нужно наполовину разбавить водой.
Работать следует в резиновых перчатках и обязательно в защитных очках или маске. При попадании электролита на кожу нужно обильно промыть место попадания нейтрализующим раствором, а после промывки глаз немедленно обратиться к врачу.
Все работы производятся на открытом воздухе или хорошо вентилируемом помещении. Пары кислоты, выделяющиеся при приготовлении раствора (особенно в горячем состоянии) вызывают раздражение верхних дыхательных путей, выраженные сильным кашлем и отеком слизистых оболочек.
В качестве одежды в домашних условиях можно использовать ту, которую не сильно жалко, поскольку даже после промывки нейтрализующим раствором между волокнами ткани останется часть агрессивного вещества и вещи будут безнадежно испорчены.
Реакции с оксидами
С данными веществами раствор кислоты соляной тоже прекрасно взаимодействует. Оксиды – это бинарные соединения элемента с кислородом, имеющие степень окисления, составляющую -2. Всем известными примерами являются песок, вода, ржавчина, красители, углекислый газ.
Соляная кислота взаимодействует не со всеми соединениями, а лишь с оксидами металлов. Вследствие реакции также образуется растворимая соль и вода. В качестве примера можно привести процесс, происходящий между кислотой и оксидом магния, щелочноземельного металла: MgO + 2HCl → MgCl2 + Н2О.